糖尿病性ケトアシドーシス (DKA) や高血糖高浸透圧症候群 (HHS) は糖尿病の重篤な合併症である。典型的には、DKAでは代謝性アシドーシスとケトン血症を呈し、血糖値は < 800 mg/dL (多くは 350-500 程度) である。HHSではケトンの蓄積はあってもごく軽度で、血糖値はときに > 1000 mg/dL となり、血清浸透圧は 380 mOsm/kg に達する。しかし、およそ3分の1の症例ではDKAとHHSの病態が混在する。
ここでは上記の高血糖緊急症の治療について述べる。特記なき限り、UpToDateの情報をもとに記す。
DKA/HHSの治療の概略
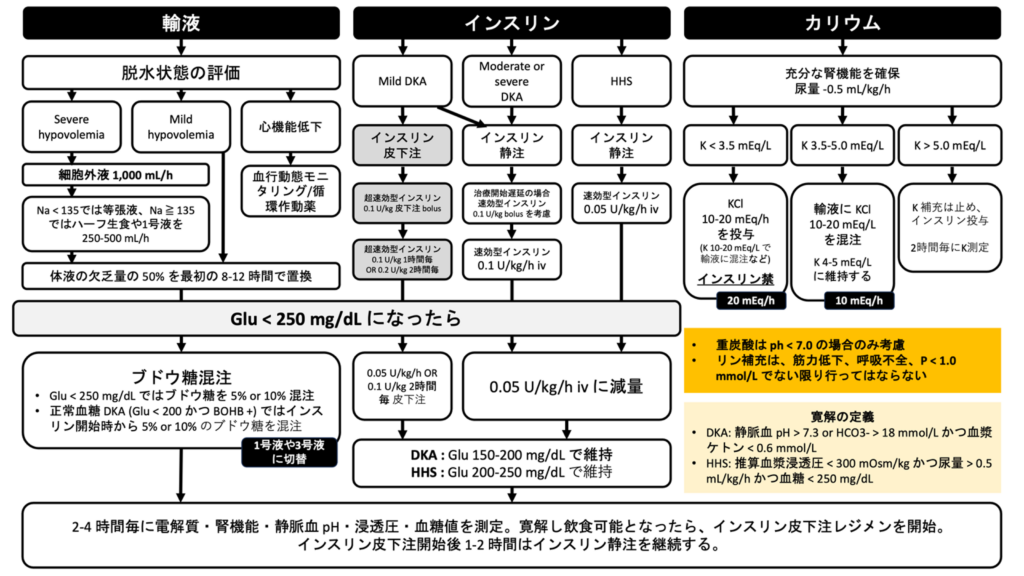
輸液
DKA/HHSに対する輸液投与の意義は下記の通り1。インスリンを投与していない段階でも、輸液のみで血糖値は 50-70 mg/dL/h 低下すると報告されている2。
- 有効循環血漿量を回復させる
- 組織還流を増やして乳酸を下げる
- 腎血流を増やしてグルコースやケトン体の腎排泄を促す
- 電解質を補正する
- 血漿浸透圧を下げる
- 脱水を補正することで拮抗するホルモンを低下させ、インスリン感受性を改善させる
等張液の選択: 生食 vs ラクテック
はじめは等張液を投与するのが通常である。生理食塩水か等張晶質液 (例: 乳酸リンゲル (ラクテック) など) を用いる。生理食塩水と等張晶質液を直接比較した試験は存在しないが、サブグループ解析では、等張晶質液のほうが短時間でDKAを解消させられ、入院期間を短縮させられたとの報告もある3。生理食塩水の多量投与は高Cl性のアニオンギャップ非開大性代謝性アシドーシスをきたすおそれがあり、ICU入室期間・入院期間が伸びることが報告されている。
ブドウ糖混注
来院時の血糖値が < 250 mg/dL である場合には、はじめから輸液にグルコースを混注する必要がある。来院時に高血糖であっても、治療介入によって血糖値が低下した場合には、グルコース混注を開始する。
- Umpierrez, G. E. et al (2024): 血糖値が < 250 mg/dL となったら、生理食塩水に 5-10%の dextrose (D-glucose) を含めるようにする
- 内科診療ことはじめ: 血糖値 ≦ 200 mg/dL となったら1号液か3号液に切り替える4
初期輸液 (等張液) の流速
- UpToDate: 15-20 mL/kg/h (体重は除脂肪体重; 平均的な体格では 1000 mL/h5) で投与を開始し、4時間で < 50 mL/kg に収まる範囲で数時間投与する。
- Umpierrez, G. E. et al (2024): 500-1000 mL/h を最初の2-4時間で投与する。体液の推定欠乏量を 24-48h で補正するようにする。
- 内科診療ことはじめ: 細胞外液 1000 mL/h を最初の1時間で投与する
なお、急速な浸透圧補正は脳浮腫の原因となりうるので、ボーラス投与は循環血液量減少性ショック (hypovolemic shock) をきたしている場合に限定する。
次の輸液の選択
Volume、電解質、尿量をみて次の輸液を選択する。
- UpToDate: 血糖補正Na値が < 135 mEq/L の場合は等張液を 250-500 mL/h で継続する。≧ 135 mEq/L の場合はハーフ生食を 250-500mL/h で投与する。
- 内科診療ことはじめ: 脱水補正を継続する場合は細胞外液を 250-500 mL/h で継続する。補正Na高値の場合はハーフ生食か1号液に切り替える。
日本ではハーフ生食の代わりに1号液を用いることもできるが、糖を含むことに注意する6。また、浸透圧利尿の影響があるため、尿量で体液量を評価することはできない。
腎臓や心臓の機能が低い場合
医原性の volume overload をきたしやすいことに留意する。等張液を持続投与するよりも、250 mL など少量の等張液のボーラス投与を反復する手法もある。
カリウム補正
DKAでは、高血糖による浸透圧利尿によって尿中へのNa排泄が増加することと、これがアルドステロンの分泌を促すことにより、尿中へのK排泄が増加する。このため体内のカリウムの総量は不足していることがほとんどである。しかし、インスリン欠乏や浸透圧上昇、アシドーシスによってKが細胞外に移動するため、検査値の見かけ上は正常〜上昇にみえる。
インスリン投与によってカリウムの分布は速やかに正常化するため、血清K値は急速に低下する。したがって、DKA治療においては、低Kの補正が重要となる。
K < 3.5 mEq/L の場合
インスリンを投与してはいけない。KCl 10-20 mEq/h を投与する。場合によっては、CV確保のうえ高濃度のKCl製剤を投与する必要がある場合もある。
K 3.5-5.0 mEq/L の場合
KCl 10-20 mEq を投与する。
K > 5.0 mEq/L の場合
K補充を中止する。2時間毎にK値をフォローする。
K値によるK補正の判断
- K > 5.3 mEq/L:K補正必要なし
- 3.3 < K < 5.2 mEq/L:K含有輸液に切り替える 補正:10 mEq/hr
- K < 3.3 mEq/L:インスリン中止し、K補正を優先 補正:20 mEq/hr
- K補正液の組成:生理食塩水 500 mL + KCl 20 mEq 混注 (40 mEq/L)
内科診療ことはじめ p675-676
成書によるが、概ね K 3 mEq/L, 5 mEq/L を閾値として判断すればよいよう。
インスリン
DKAに対するインスリン投与開始時期には議論があるが、UpToDateでは K ≧ 3.5 mmol/L である限りすみやかにインスリンを開始すべきとしている。以下の機序により、インスリンは血糖値を下げ、ケトン体の産生を抑制する。
- 糖新生の抑制
- 末梢での糖利用の促進
- 脂肪分解とグルカゴン分泌を抑制することによるケトン体産生の抑制
- ケトン体利用の促進?
血糖値を下げるよりもはるかに少ない量のインスリンで脂肪分解・ケトン体産生は抑制されるため、血糖値を下げられていれば、ケトン体産生の抑制には十分な量のインスリンを投与できていると考えられる。
重症の場合 (moderate to severe DKA)
インスリンの初期流量
速効型インスリン (regular insulin:ヒューマリンR または ノボリンR) を 0.1 単位/kg/h で持続静注する。DKAの急性期治療においては、速効型インスリンと超速効型インスリン (グルリジン; 商品名アピドラ) の効果と安全性は同等であることが示されているが7、日本では速効型インスリンを用いるのが一般的ではあろう (私見)。
静脈ライン確保困難などのためにインスリン投与が遅れた場合は、速効型インスリン 0.1 単位/kg の bolus 投与を行ってから持続静注を開始する。
インスリン流量の調整
上記のインスリン投与により、50-70 mg/dL/h (または 75-100 mg/dL/h) の血糖降下が得られることが通常である。血糖降下がこれに満たない場合には、インスリン投与経路の異常を確認したうえで、目標の降下度に達するまで、1時間毎にインスリン流量を2倍に増量する。
血糖値が < 250 mg/dL となったら、輸液に 5~10% の糖を付加する (1号 or 3号液に変える) とともにインスリンの流量を 0.05 単位/kg/h に変更する。脳浮腫を防ぐため、血糖値が急速に200未満となることは回避するべきである。
DKAが解消するまでは、血糖値は 150-200 mg/dL で管理する。急性期治療における持効型インスリン皮下注の併用要否に定まった見解はない。
軽症の場合 (Uncomplicated mild to moderate DKA)
uncomplicated DKA では、筋注・皮下注・静注いずれの経路でインスリンを投与しても効果と安全性は同等であることが示されており、超速効型インスリン (rapid-acting insulin analogs:リスプロ、アスパルトなど) の皮下注射で治療可能であると UpToDateには記載されている。ただし、日本でDKAを治療する規模の病院では、シリンジポンプを比較的容易に使用可能であると考えられる。看護師の手技の手間を考えると、あえて試みる必要は現時点ではない (私見)。今日の臨床サポートでも、同様の報告については触れたうえで、「現段階では推奨されない」としている。
皮下注射で治療を行う場合、最初に 0.1 単位/kg の超速効型インスリンをボーラス投与する。その後、0.1 単位/kg 1時間ごと、または 0.2 単位/kg 2時間ごとで、超速効型インスリンを投与する。血糖値が < 250 mg/dL となったら、インスリン投与量を 0.05 単位/kg/h または 0.1 単位/kg/2時間 に減量し、輸液に5~10%の糖を付加する。
正常血糖DKAの場合 (Glu < 200 mg/dL)
mild to moderate DKA と同様に治療すればよい。ただし、はじめから輸液には5-10%の糖を混注する。超速効型インスリンの投与は行わない (UpToDate 記載)。インスリンの初期投与量は 0.05 単位/kg/h または 0.1 単位/kg/2時間 とする。SGLT2阻害薬に関連している場合には直ちに内服中止とする。DKA軽快後もSGLT2阻害薬内服再開は推奨されない。
インスリン静注製剤の組成
- ヒューマリンR 50 単位 (0.5 mL) + 生理食塩水 49.5 mL (内科診療ことはじめ、内科レジデントの鉄則)
→ 1 単位/mL となるので、X mL/h = X 単位/h となる。 - 生理食塩水などメインに用いている輸液製剤 500 mL + ヒューマリンR 50 単位 = 0.1 単位/mL (自験例)
→ 輸液ポンプで流速を「(体重) mL/h」に設定すると、0.1 単位/h で投与できる
重炭酸の投与
重炭酸ナトリウムの投与の是非は定まっていないが、以下の場合には投与を検討する。
pH < 7.0 のアルカレミアの場合
意識障害があり、pH < 7.0 の重症のアシドーシスがある場合は、重炭酸の投与を考慮してもよい。心収縮力の低下や血管拡張が組織還流を障害しうる。pH ≧ 7.0 ではインスリンと輸液のみで代謝性アシドーシスを改善させられるため、重炭酸は不要と考えられている。
- メイロン 40 mL + 注射用水 160 mL を1時間で点滴 (今日の臨床サポート)
- 100 mmol of sodium bicarbonate in 400 mL sterile water. 2時間かけて (UpToDate)
DKAにおいては、重炭酸投与のエビデンスはない。pH 6.90-7.14 の DKA 21症例におけるランダム化試験では、重炭酸投与の有無で死亡率の有意差はなかった。pH < 6.90 の症例に関して、臨床試験は報告されていない。
なお、重炭酸投与には潜在的にリスクが伴う。動物実験レベルでは重炭酸投与によってケトン産生が亢進することが示唆されており、臨床試験でも重炭酸投与による6時間程度の治癒遅延が指摘されている。また、治療後に代謝性アルカローシスにいたる可能性もある。
K > 6.4 mEq/L または高Kによる心電図変化がある場合
致死的なレベルの高カリウム血症の場合には、Kの細胞内移行を期待し、重炭酸を投与することがある。重炭酸投与に踏み切るべきK値の閾値は明らかになっていないが、UpToDate の筆者らは > 6.4 mEq/L か心電図変化がある場合に重炭酸を投与すると記載している。
リンの補正
ルーティンにリン補正を行うことは推奨されない。P < 1 mg/dL の重篤な低P血症の場合はリン投与を考慮する。DKA患者のRCTでは、ケトアシドーシスのさなかにリン補正を行うことの有益性は証明されておらず、リン補正そのものによって低Ca血症や低Mg血症をもたらす危険性もある
脚注
- Umpierrez, G. E. et al (2024). Hyperglycaemic crises in adults with diabetes: a consensus report. Diabetologia. doi: 10.1007/s00125-024-06183-8. ↩︎
- 上記 Umpierrez, G. E. et al (2024). ↩︎
- Self, W. H. et al (2020). Clinical Effects of Balanced Crystalloids vs Saline in Adults With Diabetic Ketoacidosis: A Subgroup Analysis of Cluster Randomized Clinical Trials. JAMA New Open. doi: 10.1001/jamanetworkopen.2020.24596.; 上記 Umpierrez, G. E. et al (2024). ↩︎
- 米国には日本のような1〜4号液はないようである。1号液は2~3%、3号液は2~5%の糖を含むので、確かに血糖低下時の輸液としては妥当である。 ↩︎
- UpToDate の記載なので米国基準での平均的な体格ではあるかもしれないが、日本国内の今日の臨床サポート、内科診療ことはじめなどでも 1000 mL/h との記載があり、大きくは変わらないものと考える。 ↩︎
- 内科診療ことはじめ p675 ↩︎
- https://pubmed.ncbi.nlm.nih.gov/19366972/ ↩︎




コメント